Основные положения
- Во время беременности развивается физиологическая анемия. Уровень гемоглобина выше 11 г/дл Ненормален.
- У беременных с серповидно-клеточной анемией (HbSS) повышен риск осложнений матери и плода, включая риск перинатальной смерти. У беременных с серповидно-клеточной аномалией эритроцитов (HbAS) повышен риск папиллярного некроза и пиелонефрита.
- Беременность является гиперкоагуляционным состоянием, пик которого приходится на послеродовый период. Беременность повышает риск тромбоэмболических заболеваний, который выше у пациенток с сопутствующими коагуляционными дефектами.
- До 10% беременностей сопровождаются тром- боцитопенией, и в большинстве случаев она не имеет последствий ни для матери, ни для плода. Необходимо исключить патологические тромбоцитопенические состояния, такие как гемолиз; HELLP-синдром; тромбоцитопеническая тромботическая пурпура — синдром гемолитической анемии (ТТП); синдром диссеминированного внутрисосудистого свертывания (ДВС); идиопатическая тромбоцитопеническая пурпура (ИТП).
- Болезнь Виллебранда встречается с частотой 1 на 10 000 пациенток. У большинства страдающих этим заболеванием пациенток в течение беременности наблюдается улучшение, однако около 20% осложнены кровотечениями в послеродовом периоде.
Обзор гематологических изменении при физиологически протекающей беременности
Анемия беременных Масса эритроцитов при беременности увеличивается на ро—30%, в то время как увеличение объема плазмы доходит до 50%. Это становится причиной физиологической анемии беременных, пик которой приходится на 30-34-ю неделю беременности. В среднем гематокрит матери к моменту родов 33-34%. Анемия снижает вязкость крови, что улучшает перфузию плаценты, минимизирует изменения перфузии при изменении положения тела матери, снижает системное сосудистое сопротивление матери, и частично компенсирует кровопотерю матери во время родов (во время родов через нормальные родовые пути средняя кровопотеря составляет 300-500 мл и достигает 600-1000 мл при кесаревом сечении). Гемодилюция и снижение вязкости крови могут также компенсировать повышение уровня фибриногена и агрегации тромбоцитов, сопровождающие беременность. Увеличение числа эритроцитов происходит в результате повышения уровня эритропоэтина и человеческого плацентарного лактогена и требует поддержания адекватных уровней железа, фолата и кобаламина (В12). Если сделать это не удается, развивающаяся гемодилюция может сопровождаться повышением риска преждевременных родов и задержки роста плода.
Уровень гемоглобина ниже 10,5 г/дл или гематокрит менее 32% представляют уровень анемии превышающий ожидаемый. Такие уровни могут быть признаками истинной анемии, нуждающейся в дальнейшем исследовании. Далее в этой главе анемия обсуждается более детально.
Лейкоцитоз
Лейкоцитоз во время нормальной беременности обычен. На ранних сроках беременности количество лейкоцитов может достигать верхней границы нормы для небеременных пациенток. В третьем триместре его рост может достигать 15 000-18 000/ммЗ. Во время последнего месяца беременности число лейкоцитов имеет тенденцию к снижению, однако к моменту родов вновь вырастает до 15 000-20 000/ммЗ. В родах иногда можно наблюдать до 25 000/ммЗ лейкоцитов. Считается, что такой лейкоцитоз есть следствие повышенного уровня кортизола плазмы. При дифференциальном анализе лейкоцитов можно наблюдать незначительное количество миелоцитов и метамиелоцитов, в цитоплазме лейкоцитов могут присутствовать тельца Дойля. Несмотря на увеличение количества, функция лейкоцитов часто снижена, с ослаблением хемотаксиса и адгерентности, начинающимся во втором триместре и продолжающимся в течение всей беременности. Это может несколько повысить восприимчивость беременной женщины к инфекции и отчасти объяснить улучшение течения некоторых аутоиммунных заболеваний во время беременности.
Изменения тромбоцитов при беременности В связи с повышением во время нормальной беременности объема плазмы и, возможно, вследствие компенсаторного сла- бовыраженного внутрисосудистого свертывания в пределах маточно-плацентарного комплекса, возможно снижение числа тромбоцитов при беременности, число тромбоцитов может достигать 20% от исходного, хотя обычно остается в пределах нормы. Снижение данного показателя наиболее выражено после 32 недель беременности. Тромбоцитопения, определяемая как число тромбоцитов менее 150 000/ммЗ, встречается у 5-10% беременных. Около 25% женщин имеют для этого серьезную причину: гестоз, гемолиз, HELLP-синдром, тромбоцитопеническая тромботическая пурпура — синдром гемолитической анемии (ТТП), синдром диссеминированного внутрисосудистого свертывания (ДВС) и идиопатическая тромбоцитопеническая пурпура (ИТП). Большинство же беременных женщин с тромбоцитопенией не будут иметь клинических проявлений снижения числа тромбоцитов в анамнезе. Если при внимательном исследовании причины тром- боцитопении идентифицировать не удается, то ее называют гестационной тромбоцитопенией. Число тромбоцитов у этих женщин обычно снижается в третьем триместре и возвращается к норме вскоре после родов. Это состояние не сопровождается тромбоцитопенией плода, выбор способа родоразрешения полностью основывается на акушерских показаниях Некоторые пациентки с гестационной тромбоцитопенией могут иметь более доброкачественную форму ИТП, что проявляется присутствием у матери антитромбоцитарных антител [2]. У пациентки с клинически значимой ИТП, обычно проявляющейся на более ранних сроках беременности, число тромбоцитов может быть менее 50 000/ммЗ. Подробно это заболевание будет обсуждено ниже.
Гемостаз при беременности
Нормальная коагуляция
Система гемостаза состоит из сложного комплекса процессов, ограничивающих кровопотерю формированием скоплений тромбоцитов (первичный гемостаз) и продукцией полимера фибрина (вторичный гемостаз), связывающих скопления тромбоцитов. Контррегуляцию этих процессов осуществляет фибринолитическая система, которая ограничивает размер формирующегося фибринового сгустка, таким образом предупреждая избыточное тромбообразование. Существуют врожденные и приобретенные патологии обеих этих систем, и у пациенток с нарушениями гемостаза возможны повышенная кровоточивость, избыточное тромбообразование или их сочетание [3].
Первичный гемостаз есть взаимодействие тромбоцитов с субэндотелием сосудов, ведущим к формированию скоплений тромбоцитов в месте повреждения. Для того чтобы это произошло, необходимы следующие компоненты: нормальный субэндотелий сосудов (коллаген), функционирующие тромбоциты (способные к адгезии, секреции, аггрегации и стимуляции прокоагулянтной системы), нормальный фактор Виллебранда (прикрепляет тромбоциты к эндотелию при помощи гликопротеина lb) и нормальный фибриноген (скрепляет тромбоциты между собой при помощи гликопротеинов IIь и IIIа). На рис. 16—1 приведена упрощенная схема первичного гемостаза.
Вторичный гемостаз описывает реакции коагулирующих протеинов плазмы (факторы свертываемости) посредством жестко регулируемых механизмов. Эта система обычно триггируется тканевым фактором, стимулирующим активизацию фактора VII (этот путь называется внешний путь). Активированный фактор VII, в свою очередь, стимулирует как внутренний, так и общий путь до того, как он быстро инактивируется. Финальным продуктом становится активированный тромбин, вызывающий конверсию фибриногена в фибрин-мономер и, в конце концов, в полимер фибрина. Последний нерастворим и связывает скопления тромбоцитов, образуя сгусток. На рис. 16-2 представлена диаграмма реакций вторичного гемостаза.
Фибринолитическая система — это сложная система, регулирующая механизм гемостаза ограничением размера формирующегося фибринового сгустка (рис. 16-3).
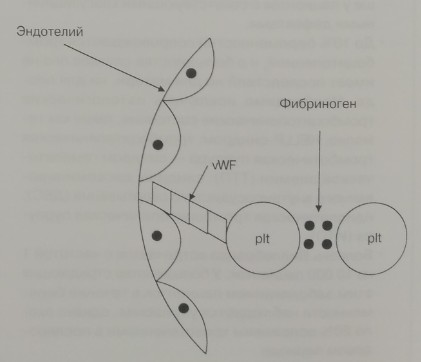
Рис. 16-1. Первичный гемостаз (объяснения см. в тексте). vWF — фактор Виллебранда; pit — тромбоциты.
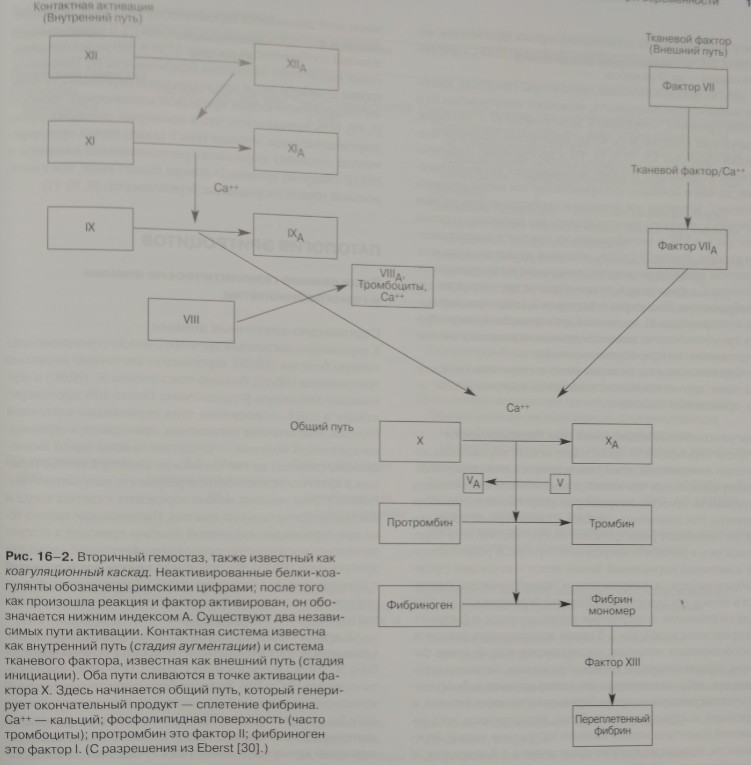
Рис. 16-2. Вторичный гемостаз, также известный как коагуляционный каскад. Неактивированные белки-коагулянты обозначены римскими цифрами; после того как произошла реакция и фактор активирован, он обозначается нижним индексом А. Существуют два независимых пути активации. Контактная система известна как внутренний путь (стадия аугментации) и система тканевого фактора, известная как внешний путь (стадия инициации). Оба пути сливаются в точке активации фактора X. Здесь начинается общий путь, который генерирует окончательный продукт — сплетение фибрина. Са++ — кальций; фосфолипидная поверхность (часто тромбоциты); протромбин это фактор II;
Другие физиологические ингибиторы гемостаза, имеющие клиническую значимость, включают антитромбин III и систему протеин С — протеин S. Антигромбин Ш — это белок, образующий комплексы со всеми протеазами факторов коагуляции (факторы ХП, XI, X, IX, VII и протромбин) и ингибирующий их функцию. Гепарин потенциирует это взаимодействие, на чем и основано его применение как антикоагулянта. Протеин С, которому для активации необходимо присутствие протеина S, способен инактивировать два кофактора плазмы, факторы V и VIII, и ингибировать их участие в коагуляционном каскаде. Фактор V Leiden, типичная врожденная прокоа- гулянтная мутация, блокирует связывание активированного протеина С с фактором V, таким образом предупреждая его ингибирование. Пациентки с фактором V Leiden или дефицитом антитромбина III, протеина С или протеина S могут страдать тромбоэмболическими заболеваниями и иметь в анамнезе привычную потерю беременности.
Скрининговые тесты первичного и вторичного гемостаза, а также другие, типично используемые коагуляционные тесты, приведены в табл. 16-1.
Коагуляционные изменения при беременности
Во время беременности происходит немало выраженных изменений в механизме гемостаза, ведущих к гиперкоагуляционному состоянию, что является подготовкой к возможным нагрузкам на гемостаз во время родоразрешения и отделения плаценты. Эти изменения снижают кровопотерю во время рейдов, но повышают риск тромбоза на протяжении всей беременности и в раннем послеродовом периоде. В результате таких изменений нормальный баланс между коагуляцией (тромбообразованием) и фибринолизом (тромболизисом) смещается в пользу последнего [5,6] Влияние беременности на факторы свертывания, естественные антикоагулянты, и фибринолиз приведены в табл. 16-2. В целом концентрация факторов, способствующих гемостазу, увеличивается; в то же время факторы, ограничивающие тромбообразование, остаются неизменными, либо их концентрация слегка снижается. Фибринолитическая система во время беременности менее активна, и ее реакция на стимуляцию ослаблена. Большую часть этих изменений гемостаза можно выявить на третьем месяце беременности, возврат же к норме происходит к 4-й неделе после родов. Показатели фибринолитической системы возвращаются к нормальным уровням в течение 1 ч после рождения плаценты, так как вместе с ней исчезает продуцируемый ею ингибитор фибринолиза — активатор плазминогена 2.
Димеризированный фрагмент плазмина D (D-димер) является маркером активации коагуляции, используемым для диагностики тромбоза глубоких вен и артерий и легочной тромбоэмболии (ТЭЛА). Он представляет собой продукт разрушения полимера фибрина плазмином. Для измерения уровней D-димера применяют методики ELISA и латексной агглютинации, чувствительность и специфичность при диагностике тромбоза варьирует в зависимости от типа исследуемой пробы. В целом у небеременных пациенток уровень менее 500 нг/мл указывает на низкий риск тромбоза.
Однако ценность исследования D-димера для диагностики венозного тромбоза у беременных ограничена. Уровень повышается после первого триместра и продолжает расти в течение всей дальнейшей беременности, при родах, родоразре- шении и непосредственно после родов [7]. В одном из исследовании сообщается об уровнях 1750 ± 839 нг/мл при отсутствии какой-либо патологии беременности [8]. Повышение уровня D-димера per sc при нормальной беременности нс является прогностическим признаком клинического тромбоза [9,10]. Есть данные о том, что в некоторых ситуациях (преждевременные роды, мутация гена V Leiden, гестоз, преждевременная отслойка нормально расположенной плаценты и HELLP-синдром) уровень D-димера бывает выше, чем в контрольной группе (нормальные беременности).
